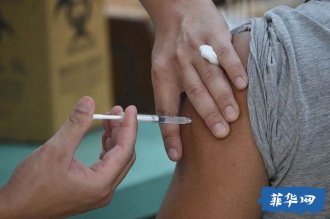
首个国产口服新冠药获批!国内新冠药物研发上市或将提速
7月25日,国家药品监督管理局官网显示,根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。

同时,国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
当晚,复星医药公告称,公司控股子公司复星医药产业与真实生物签订《战略合作协议》,就推进双方联合开发并由复星医药产业独家商业化阿兹夫定等事宜达成战略合作。对此,复星医药方面回复《华夏时报》记者称,目前一切以公告为准。
真实生物首个冲线 已具备大规模商业生产能力
公开资料显示,阿兹夫定是真实生物研发生产的首个双靶点抗HIV-1药物,2021年7月20日,国家药监局已附条件批准本品与其他逆转录酶抑制剂联用治疗高病毒载量的成年HIV-1感染患者。
2020年2月,阿兹夫定被发现可以抗新冠病毒后,同年4月便被国家药监局批准开展抗新冠病毒Ⅲ期临床试验。2021年,阿兹夫定获得国外治疗新型冠状病毒肺炎Ⅲ期临床批件。
此前,国家药监局药品审评中心公布的沟通交流公示信息显示,真实生物分别于今年3月10日、4月2日申请Ⅱ类会议和Ⅲ类会议,状态均为“已反馈”。这一变化也被市场认为是三期临床试验即将临床揭盲、申报上市。
7月15日,真实生物宣布阿兹夫定片治疗新型冠状病毒性肺炎适应证注册Ⅲ期临床试验结果达到预期,近日已正式向国家药品监督管理局提交上市申请。
7月25日,国家药监局附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请,用于治疗普通型新型冠状病毒肺炎(COVID-19)成年患者。
这意味着,真实生物的阿兹夫定片成为国内首款自主研发的口服小分子新冠治疗药物。
根据国家药监局要求,上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。据了解,附条件批准上市是指用于严重危及生命且尚无有效治疗手段的疾病、公共卫生方面急需的药品,其现有临床研究资料尚未满足常规上市注册的全部要求,但已有临床试验数据显示疗效并能预测其临床价值,在规定申请人必须履行特定条件的情况下基于替代终点、中间临床终点或早期临床试验数据而批准上市。
疗效方面,阿兹夫定III期临床试验结果显示,阿兹夫定可以显著改善临床症状,显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,并且具有抑制新冠病毒的活性,病毒清除时间为5天左右。在安全性方面,阿兹夫定片总体耐受性良好,不良事件发生率阿兹夫定组与安慰剂组无统计学差异,未增加受试者风险。
记者梳理发现,真实生物早已为阿兹夫定片的生产和商业化铺路。
今年4月份以来,真实生物相继与A股上市公司新华制药、华润双鹤、奥翔药业签订合作协议。6月29日,阿兹夫定片的备案信息变更,生产企业名称由北京协和药厂变更为河南真实生物科技有限公司、北京协和药厂有限公司。这意味着真实生物是阿兹夫定片的上市许可持有人,并获得了阿兹夫定片的生产许可资质。
据《河南日报》26日报道,阿兹夫定制剂企业现已具备大规模商业生产能力,年产能68亿片左右,能满足近2亿人的治疗需求。“作为新建企业,我们将持续做好该药品全生命周期质量管理,以最快的速度将药物推向市场。”河南真实生物科技有限公司CEO兼CSO杜锦发说。
6月2日,新华制药在公告中提示,与真实生物达成的只是初步战略性合作协议,目前尚未签署任何相关产品的具体合作协议,并且该战略合作协议并无排他性,新华制药并非真实生物的唯一合作方。
7月25日,复星医药宣布与真实生物达成战略合作,双方将联合开发并由控股子公司复星医药产业独家商业化阿兹夫定,合作领域包括新冠病毒、艾滋病治疗及预防领域。双方将依托各自优势,在中国境内(不包括港澳台地区)及未来可能在中国权益以外的全球地区(不包括俄罗斯、乌克兰、巴西及其他南美洲国家和地区)开展合作。
“我们很高兴能与真实生物达成战略合作,并将持续推进在新冠病毒的治疗及预防领域的联合开发,希望充分利用复星医药多年积累的创新能力、商业化能力以及国际化优势,将阿兹夫定片这款中国自主创新研发的小分子口服药带给全球更多患者,切实满足一线临床用药需求,助力疫情防控。”复星医药首席执行官文德镛表示。
君实、开拓紧随其后 多元化治疗可期
7月25日,在全国药品监督管理工作电视电话会议上,国家药监局方面明确提出“加快新冠病毒治疗药物研发上市速度”。
随着阿兹夫定的获批上市,其他“选手”的上市进展也引发关注。
西南证券最新研报显示,目前除真实生物的阿兹夫定获批外,国产新冠口服药处于研发后期的药物还包括君实生物的VV116以及开拓药业的普克鲁胺等。此外,有10余款国产新冠口服药处于研发早期。
君实生物相关负责人对《华夏时报》记者表示,目前公司已就药学、药理毒理学和药物临床试验等相关研究工作向国家药品监督管理局药品审评中心(下称“药审中心”)递交新药上市许可申请前沟通交流会议申请。如经沟通交流,药审中心认为现有研究数据满足药品上市许可的技术要求,公司将提出 VV116 药品上市许可申请,即按照药品注册申报资料要求向药审中心提交 VV116 相关研究资料。至于上市时间,暂时没有给到外界预期。
开拓药业方面则回复记者称,目前我们正和监管部门做积极沟通,希望能够尽快获批,为新冠患者带来安全有效、多样化的治疗选择。
除此之外,据先声药业透露,其3CL蛋白酶抑制剂SIM0417的II、III期临床研究将快速启动;众生药业的RAY1216进入一期临床试验;科兴制药与深圳安泰维生物医药有限公司合作开发的SHEN26胶囊,临床试验也已获得国家药监局批准同意。
国金证券研报指出,看好口服新冠药获批及后续放量潜力,以及对复工复产的积极作用。
和君咨询医疗医药事业部史万奎指出:“在新冠疫情长期持续这种大概率预判下,如何让感染后的病理反应、病程和成本下降到更低,应该是人类相对可选择的优解。就可见信息预判,新冠疫情将呈现易感性、多变性、持久性、复杂性,市场对口服药需求规模将是巨大的。具体谁更有竞争力,还要看药物的治疗效果、不良反应程度、价格、疫情变化对市场需求蛋糕的发酵程度以及营销能力等。”
了解更多请搜索: 新冠药
进入原帖,回复讨论
热点关键字
菲律宾旅游签证, 杜马盖地旅游攻略, 天使城AngelsCity, 阿普莉, 马尼拉大教堂, 黎刹公园, 苏比克旅游攻略, 菲律宾航空怎么样?, 菲律宾公共假期, 黎牙实比旅游攻略, 菲律宾签证申请, 棉兰老旅游攻略, 爱妮岛旅游攻略, 菲律宾宿务航空怎么样?, 薄荷岛旅游攻略, 百胜滩旅游攻略, 菲律宾虎航怎么样?, 加比地, 菲华吧, 菲律宾工作签证办理, 美军纪念墓园, 海豚湾旅游攻略, 民多洛旅游攻略, 菲律宾话费充值, 菲律宾旅游, 巴科洛德旅游攻略, 甲米地菠菜岛, 克拉克旅游攻略, 菲律宾结婚, 圣奥古斯丁教堂, 菲律宾亚航怎么样?, 巴拉望旅游攻略, 达沃旅游攻略, 菲律宾中文网, 菲律宾美食, 圣地亚哥城堡, 菲律宾求职, 菲律宾网址导航, 菲律宾交友网站, 菲律宾中文交友, 科隆旅游攻略, 达卡, 马尼拉教你怎么玩?, 菲律宾找工作, 长滩岛怎么样?, 椰子宫, 马尼拉唐人街, 公主港旅游攻略, 锡基霍尔旅游攻略, 菲律宾招聘, 菲律宾话费充值, 菲律宾马尼拉赌场有那些?, 海洋公园, 伊洛伊洛怎么样?, 碧瑶旅游攻略, 大雅台旅游攻略, 菲律宾留学怎么样?, 西班牙王城, 菲律宾签证, 菲华吧论坛, 菲律宾承认双重国籍吗?, 菲律宾有哪些大学?, 宿务旅游达人攻略, 八打雁旅游攻略, 佬沃旅游攻略